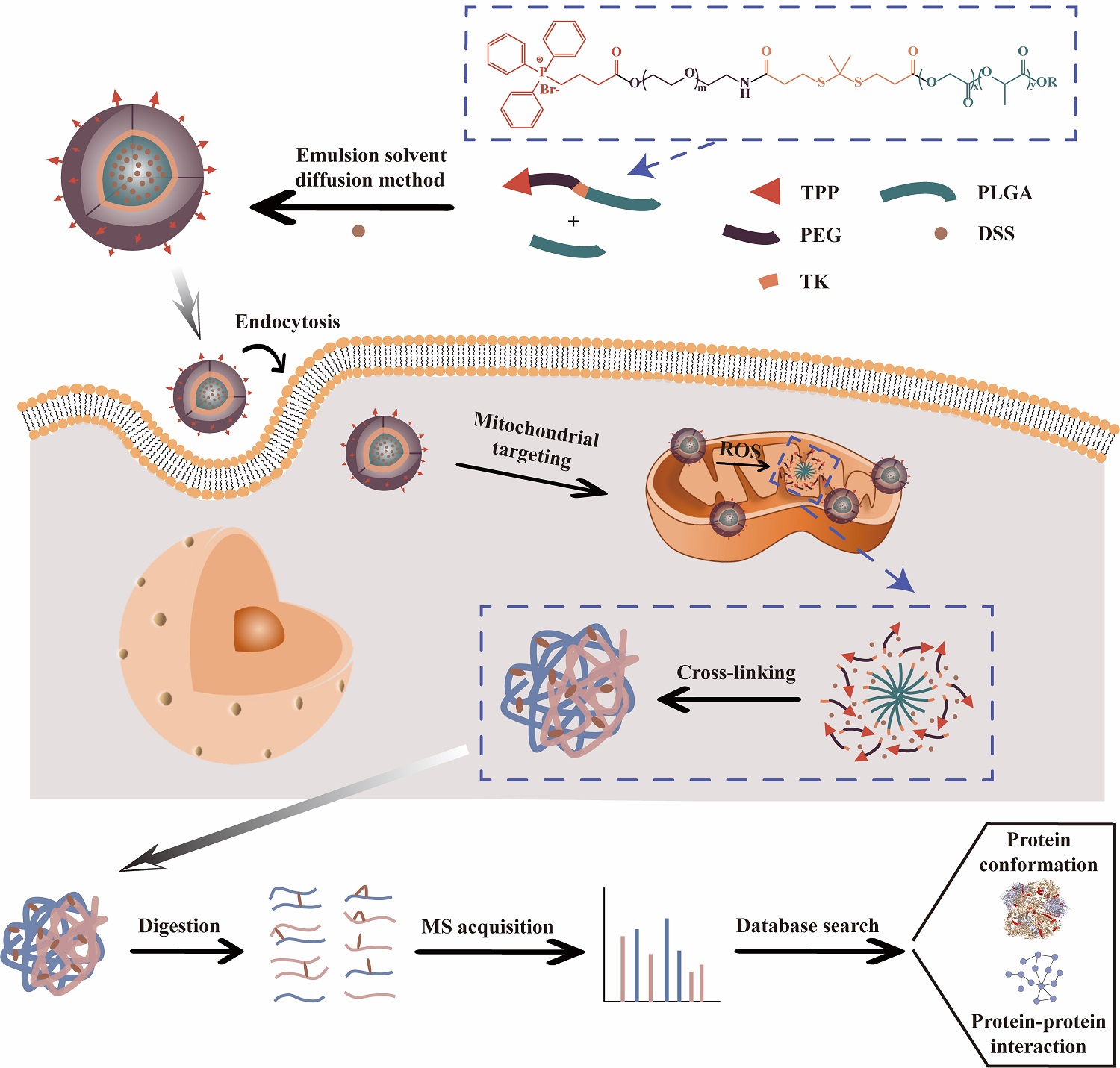
近日,我所生物技术研究部生物分子高效分离与表征研究组(1810组)张丽华研究员、杨开广研究员团队在活细胞内线粒体蛋白质原位构象和相互作用解析方面取得新进展,构建了靶向线粒体的活性氧(ROS)响应交联剂递送纳米颗粒(R-CDNP),解决了目前载体交联技术(CD-MS)中,交联剂的靶向可控释放问题,从而实现了活细胞线粒体的蛋白质原位构象和相互作用的解析。
线粒体是细胞的“发动机”,研究表明,线粒体蛋白质功能紊乱会导致多种疾病,包括代谢紊乱和神经系统疾病等。蛋白质功能很大程度上取决于其三维构象和蛋白质-蛋白质相互作用(PPI)。全面研究线粒体蛋白质构象和PPI,可以深入了解蛋白质的功能和调控机制,有助于阐明线粒体功能障碍的机制。目前,CD-MS技术主要通过纳米载体将化学交联剂递送至活细胞线粒体,实现线粒体蛋白质复合物原位交联,并利用交联质谱(CX-MS)解析线粒体蛋白质原位构象和相互作用。但是,由于CD-MS技术缺乏高活性交联剂释放的可控性,进而影响结果的准确性和覆盖度,并还有可能导致线粒体内蛋白质构象和PPI的改变或丢失。
针对这一难题,该团队利用细胞内线粒体高浓度ROS的特点,通过乳化溶剂扩散法构建了一种靶向线粒体的ROS响应交联剂递送纳米颗粒(R-CDNP),实现活细胞内线粒体的原位交联。研究发现,R-CDNP靶向线粒体后,线粒体内源性ROS触发交联剂DSS从R-CDNP中释放,以确保在对活细胞干扰较小的前提下实现线粒体的高交联覆盖度。研究团队已在HepG2细胞中鉴定了572个线粒体蛋白的2103个交联位点(PSM≥2,FDR=1)。其中,1718个蛋白质内部交联位点揭示了涉及具有ATP依赖性构象循环的伴侣蛋白的动态构象,385个蛋白质间交联位点揭示了涉及OXPHOS复合物的动态相互作用,以及27对可能的潜在相互作用。该工作为深入理解线粒体蛋白的生物功能、提供线粒体疾病治疗策略提供了关键数据支撑。
相关成果以“Targeted Analysis of Mitochondrial Protein Conformations and Interactions by Endogenous ROS-Triggered Cross-Linker Release”为题,发表在《先进科学》(Advanced Science)上,该工作的第一作者是我所1810组博士研究生周雯。研究工作得到国家重点研发计划、国家自然科学基金、中国科学院青促会等项目的资助。(文/图 周雯、杨开广)
文章链接:https://doi.org/10.1002/advs.202408462