近日,我所生物技术研究部生物分子结构表征新方法研究组(1822组)王方军研究员团队发展了整合紫外激光解离的时间分辨质谱法,实现了对氨基酸位点突变引起的靶蛋白稳定性和动态精细结构的表征,为研究靶蛋白氨基酸突变的病理机制提供了新技术。
氨基酸位点突变如何影响靶蛋白稳定性和动态结构,对于理解疾病的分子机制,以及靶向药物设计至关重要。然而,位点突变通常只能引起靶蛋白动态结构的细微变化,对其动态分子细节的表征仍面临极大的挑战。
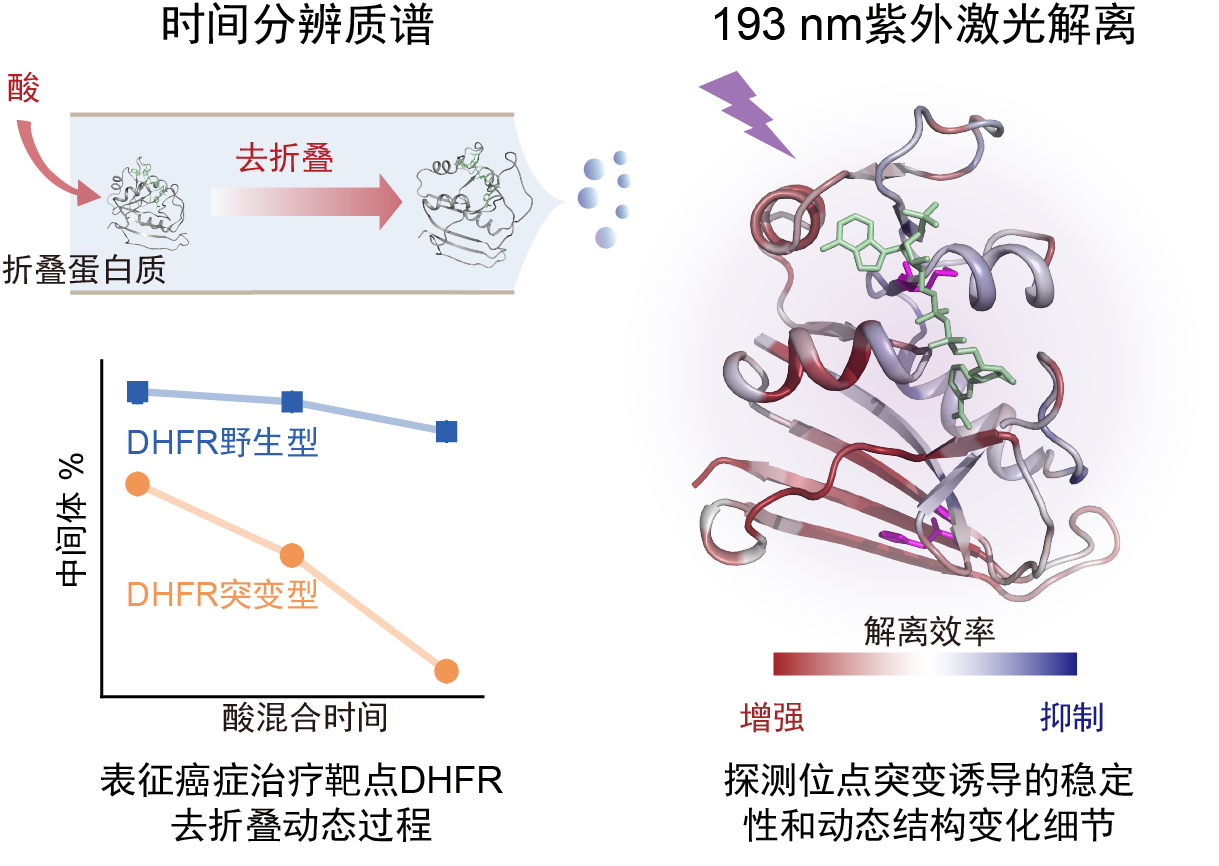
本工作中,研究团队采用在线混合甲酸溶液引起靶蛋白结构去折叠的方法,通过非变性电喷雾离子化和质谱分析,监测了蛋白质去折叠中间体和产物的电荷分布,以及其相对丰度随混合时间的变化,实现了对二氢叶酸还原酶(DHFR)M42T/H114R突变引起的稳定性变化的定量表征。此外,团队进一步采用紫外激光解离(UVPD)和碎片离子质谱方法,定量对突变体和野生型DHFR的去折叠中间体进行了动态结构和分子细节的对比。分析发现,辅因子NADPH对DHFR结构具有稳定作用,M42T/H114R位点突变可造成NADPH与DHFR的I41、Q65、V78、D79、I82和R98等氨基酸残基间的非共价作用降低,从而导致其稳定性下降。本工作为研究氨基酸位点突变引起的靶蛋白细微动态结构和病理机制提供了新技术。
王方军团队致力于极紫外激光解离质谱新仪器研制和原位化学标记-结构质谱新方法研究,在蛋白-蛋白、蛋白-药物、蛋白-纳米材料等非共价作用位点表征方面取得了系列进展(Chem. Sci.,2024;Nat Protoc.,2023;J. Am. Chem. Soc.,2023;J. Am. Chem. Soc.,2023;Cell Chem. Biol.,2022;CCS Chem.,2022;Anal. Chem.,2022;Chem. Sci.,2021)。
上述工作以“Time-Resolved Ultraviolet Photodissociation Mass Spectrometry Probes the Mutation-Induced Alterations in Protein Stability and Unfolding Dynamics”为题,于近日发表在《美国化学会志》(Journal of the American Chemical Society)上。该工作得到了国家重点研发计划、国家自然科学基金、我所创新基金等项目的资助。(文/图 罗盼)
文章链接:https://pubs.acs.org/doi/10.1021/jacs.4c00316