我所微流控芯片研究组(1807组)秦建华研究员团队在实现功能类器官可控负载与培育研究方面取得新进展,建立了一种基于双水相液滴微流控系统的杂合水凝胶微囊可控制备新体系,可高通量产生干细胞来源胰岛类器官,并利于降低其变异性。
类器官(organoids)是近年来新兴的体外3D器官模型,是生命科学领域的重大技术突破。它是一种在体外培育,由干细胞经自组装形成的多细胞三维结构,能部分模拟来源组织、器官的关键结构和功能,为发育生物学、疾病研究和药物筛选等提供一种新的研究工具。目前,类器官的产生主要依赖于干细胞(PSCs或ASCs等)在特定3D微环境中通过细胞分序、空间限制的定向分化来进行自组装。由于类器官形成过程繁琐,操作步骤多;加之所用基质多为动物来源(如Matrigel),成分复杂、理化性质不定,导致类器官在形态、组成和功能等方面表现出较高的可变性,很大程度上影响类器官的质量和高通量可控产生。
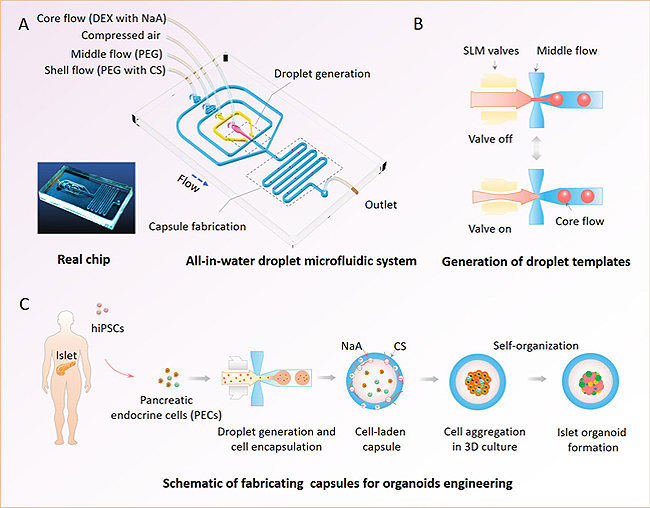
以水凝胶为代表的生物材料具有生物相容性好、理化性质可调、可模拟体内组织微环境等特点,为体外构建性能稳定、可信度高的类器官提供了新思路。本研究中,秦建华团队将工程学、材料学与干细胞发育学相结合,建立了基于双水相液滴微流控技术的杂合水凝胶微囊新体系,并用于人诱导多能干细胞(hiPSC)衍生胰岛细胞的3D培育、组装和胰岛类器官形成。过程中,研究者构建了一种可集成气动泵阀操控的微流控芯片系统,用“一步法”可控形成大量的“水包水”液滴,再经过界面络合反应,产生出负载细胞的海藻酸钠(NaA)-壳聚糖(CS)杂合微囊。这种微囊制备过程简单,生物相容性高,具有灵活可控和高通量等特点,有利于大量胰岛类器官的负载、分化和培育。由于微囊中细胞负载量可控,产生的胰岛类器官形态大小较均一,显著降低了类器官的可变性。经鉴定,微囊中形成的类器官呈现较好的细胞活性和糖刺激胰岛素分泌功能,体现了该杂合微囊体系用于工程化功能类器官的可行性。此外,这种微囊也可用于培育其它类型类器官,并可作为免疫隔离载体,在体内移植和再生医学等方面具有应用潜力。
相关研究成果发表在《尖端科学》(Advanced Science)上。上述工作得到中科院战略性先导科技专项A类“器官重建与制造”和国家自然科学基金项目等的支持。(文/图 刘海涛、王亚清)