循环肿瘤细胞(CTCs)是指从原发肿瘤组织脱落并侵袭进入血液循环系统中的肿瘤细胞,CTCs的数量能够反应癌症发展阶段和用于判断预后以及复发检测,同时,由于CTCs携带有原发灶和转移灶的遗传和表型信息,对其作进一步分析,可以指导肿瘤用药、掌握癌症的动态变化,检测抗性改变及时调整治疗方案。因此对血液中CTCs的特异性识别具有十分重要的生物学和临床意义。但是,CTCs在血液中含量极少,转移性癌症患者每毫升血液中仅为几个到几百个CTCs,其中还包含超过一百万个白细胞和十亿个红细胞,因此实现对CTCs的捕获与检测极具挑战。
分子印迹技术是基于“钥匙和锁”的原理,以分子识别理论为基础,模拟抗体-抗原相互作用,设计合成的具有特定结构和功能的人工抗体制备技术。近年来张丽华团队(1810组)发展了一系列用于生物分子识别的分子印迹技术(Adv. Mater. 2019, 31, e1902048,ACS Appl. Mater. Interfaces 2014, 6, 21954,ACS Appl. Mater. Interfaces 2016, 8, 5747,Chem. Commun. 2011, 47, 3969),并在国际上率先将其用于蛋白质组学样品预处理、重组蛋白纯化、蛋白质检测等领域(Anal. Chem. 2016, 88, 5621,Anal. Chem. 2015, 87, 4617,Anal. Chem. 2019, 91, 2591,Anal. Chim. Acta 2018, 997, 9,Chem. Commun. 2014, 50, 9521)。该技术具有的选择性高、环境耐受性好以及结构预设性强等特点,为当前CTCs富集过程中特异性抗体缺乏、抗体易失活等问题提供解决途径。
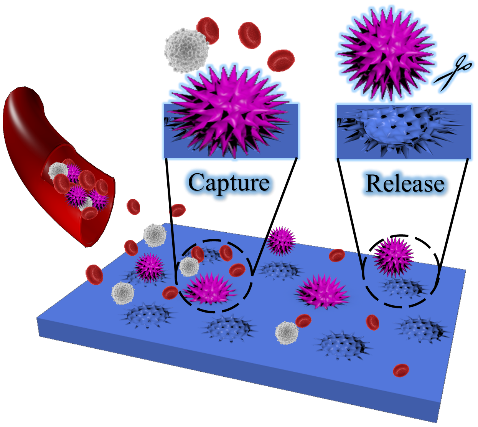
研究团队利用苯硼酸能够高选择性与肿瘤细胞表面的唾液酸相互作用的原理,发展了一种基于分子印迹与苯硼酸协同效应的人工抗体材料—3-丙烯酰胺基苯硼酸辅助细胞印迹凝胶。该材料不仅可以实现对表面EpCAM阴性的细胞(SMMC-7721)进行识别,并且1.0×105个细胞中的捕获效率达到90.31% ± 1.35%(n = 3);在1000倍的非印迹细胞即Jurkat细胞的干扰下,对SMMC-7721细胞的富集因子可达13.45 ± 3.20(n = 3);且99%的被捕获细胞可以实现无损释放,成功的实现了10 CTCs/mL血液中目标细胞的高效捕获(Small 2020, 16, e1904199.)。该研究成果不仅为其他生物模板(如细菌、病毒等)的特异性识别分子印迹材料的研制提供理论指导和相关技术,更有助于解决当前由于特异性抗体缺乏,CTCs临床检测假阴性高的问题。
以上工作得到了国家自然科学基金项目、国家重点研究开发计划项目、中科院青年创新促进会项目的资助。